
Teori Asam Basa Bronsted Lowry Pasangan Asam Basa Konjugat & Keunggulan dan Kelemahan YouTube
Teori Bronsted-Lewry disebut juga dengan pasangan asam-basa konjugasi. Menurut Lowry, asam dan basa hanya terionisasi di dalam air saja. Hal ini dikarenakan air bisa menarik ion H+ dan membentuk ion hidronium dan air melepas ion H- sehingga membentuk ion hidroksida. Baca juga: Jenis-Jenis Indikator Asam Basa.

Teori Asam Basa
Dan keduanya disebut dengan pasangan asam basa konjugasi. Agar lebih memahami teori Bronsted-Lowry tentang asam basa konjugasi, marilah kita bahas soal berikut ini! Baca juga: Larutan Asam, Basa dan Garam. Soal: Tentukan pasangan asam basa konjugasi pada persamaan kimia berikut! H2O(l) + NH3(aq) → OH-(aq) + NH4+(aq) Jawaban:

Teori Asam Basa Bronsted Lowry YouTube
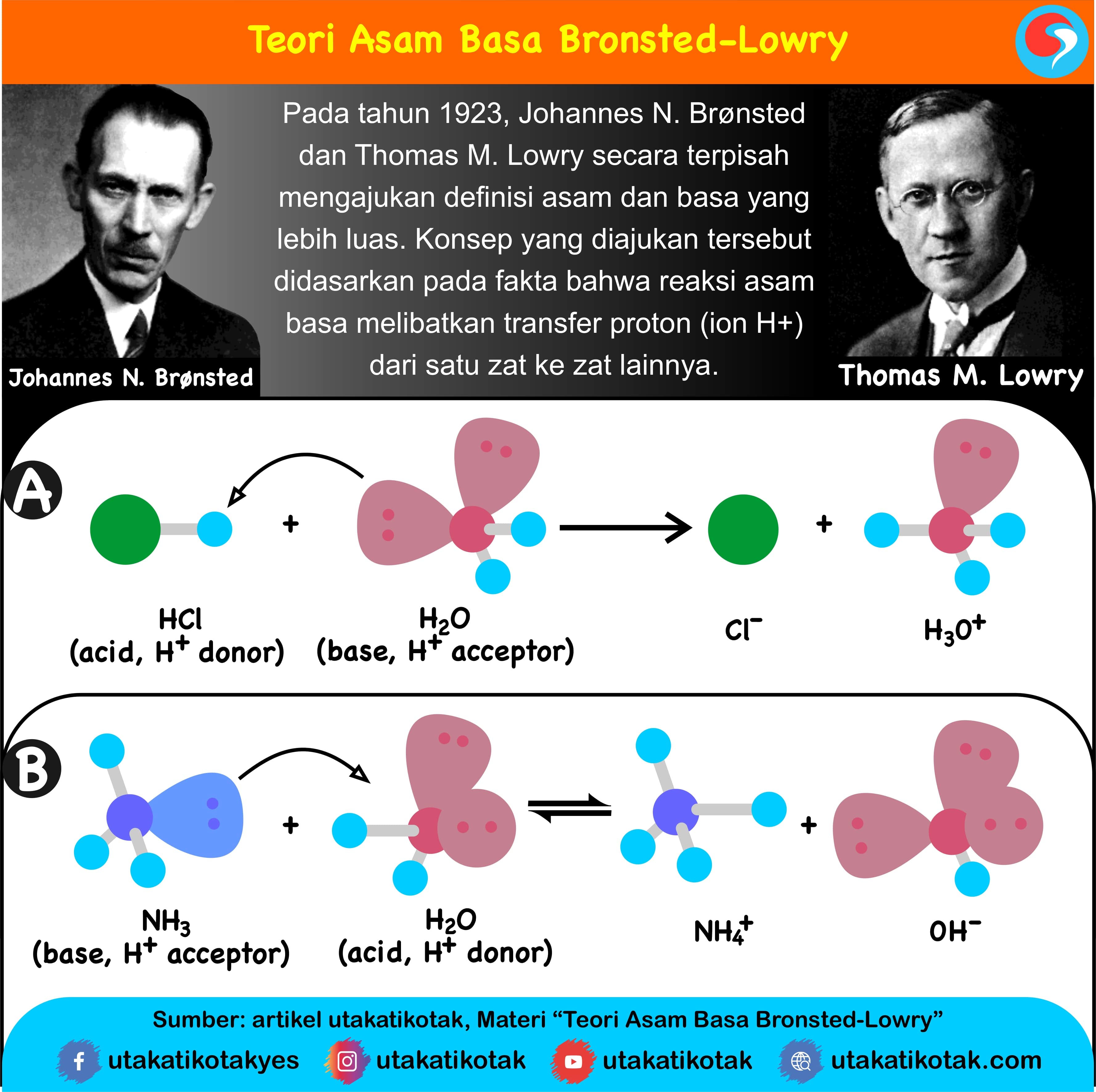
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Teori Asam Basa Bronsted Lowry Riset
Video ini berisi tentang bagaimana cara menentukan pasangan asam basa konjugasi dari suatu reaksi asam basa Bronsted-Lowry. Ini adalah materi kimia kelas 11.

SOLVED pasangan asam basa Brinsted lowry secara berurutan 6 Diketahui persamaan reaksi asam
Istilah asam-basa konjugasi ini muncul dalam Teori Asam-basa Brønsted-Lowry. Istilah asam-basa konjugasi merupakan sentral dalam bahasan kesetimbangan asam-basa di SMA/MA, yang di dalamnya terdiri bahasan larutan penyangga atau larutan bufer serta hidrolisis garam. Penentuan manakah yang termasuk pasangan asam-basa konjugasi dan basa-asam.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Pada reaksi: H 2 O + CH 3 COO − ⇌ CH 3 COOH + OH − Pasangan asam basa konjugasi menurut Bronsted-Lowry adalah.. SD. SMP. SMA. UTBK/SNBT. Teori asam dan basa menurut teori Bronsted-Lowry adalah sebagai berikut: Asam adalah spesi yang dapat mendonorkan proton dan basa adalah spesi yang dapat menerima proton..
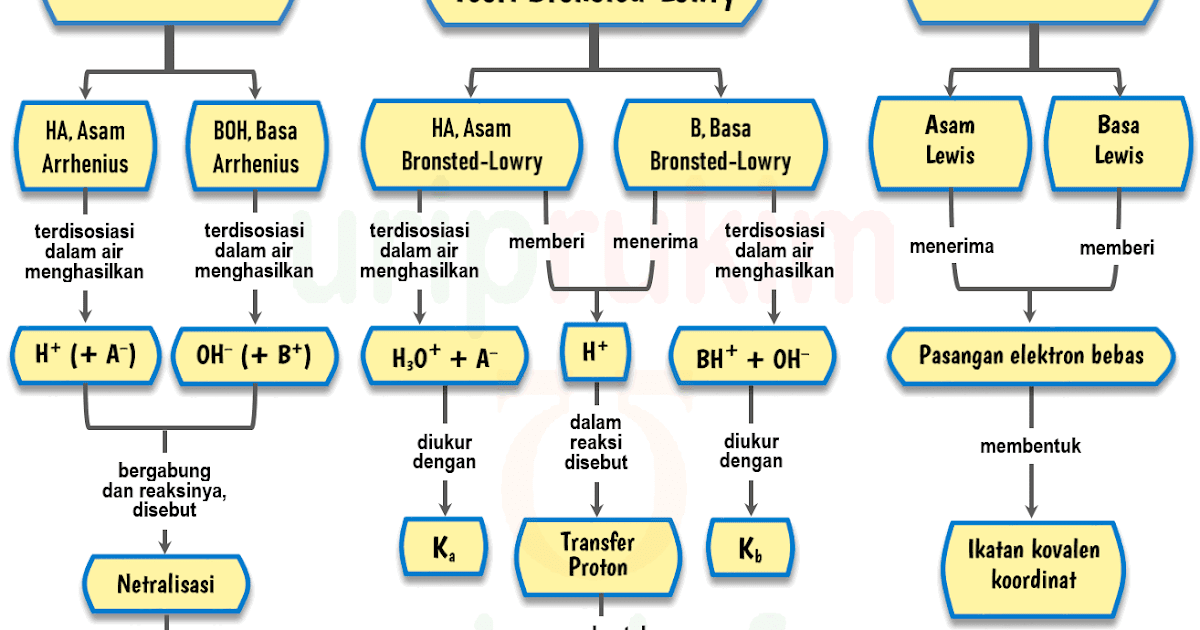
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).

Mudah😆 !! Pasangan AsamBasa menurut Teori Bronsted Lowry YouTube
Asam menurut Lewis adalah zat yang dapat menerima pasangan elektron dari zat lain, sedangkan basa adalah zat yang memiliki pasangan elektron bebas dan mampu mendonorkannya ke zat lain.. Teori asam basa Bronsted Lowry juga tidak hanya berupa molekul saja, tapi juga bisa berupa molekul, senyawa ion, dan ion (kation dan anion)..

Menentukan Asam Basa Konjugat BronstedLowry YouTube
KOMPAS.com - Menurut teori Bronsted Lowry, asam adalah spesies yang dapat mendonorkan proton.Adapun, asam Bronsted memiliki pasangan basa konjugasinya. Berikut adalah contoh pasangan asam dan basa konjugasi Bronsted Lowry!. Dilansir dari Chemistry LibreTexts, basa konjugasi adalah asam yang telah mendonorkan atau kehilangan protonnya.. Artinya, asam melepaskan proton (H+) untuk mencapai.

Tulislah persamaan reaksi asam basa dibawah ini menurut bronsted lowry dan tentukan pasangan
Sedangkan basa yang telah menerima atau menangkap proton dari asam, disebut sebagai asam konjugasi. Dan keduanya disebut dengan pasangan asam basa konjugasi. Asam: H 2 O Basa: NH 3 Asam konjugasi: NH 4 + Basa konjugasi: OH - Jadi, dapat disimpulkanjawaban asam basa konjugasi yang tepat adalah H 2 O dan OH - kemudian NH 3 dan NH 4 + .

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Pengertian Asam dan Basa Menurut Bronsted-Lowry. Kekuatan Asam Kuat dan Asam Lemah. Pasangan asam-basa setelah terjadi serah-terima proton dinamakan asam basa konjugasi. Perhatikan contoh reaksi berikut: HCl (aq). H 2 O dan H 3 O + merupakan pasangan asam-basa konjugasi.

Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923.. G.N. Lewis pada tahun 1923 memperkenalkan teori asam-basa dengan basis pada pasangan elektron. Menurut Lewis, asam adalah akseptor pasangan elektron, sedangkan basa adalah donor pasangan.

Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
Menurut Brønsted-Lowry, basa adalah spesi yang bertindak sebagai penerima (akseptor) proton. 1. Asam Basa Konjugasi. Pada teori Brønsted-Lowry, dikenal istilah pasangan asam basa konjugasi. Asam konjugasi adalah basa yang menerima proton. Basa konjugasi adalah asam yang memberi/melepas proton. 2. Contoh Persamaan Reaksi Asam Basa.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H +).
Teori Asam dan Basa Menurut BronstedLowry
Menurut Bronsted Lowry asam adalah spesies apa pun yang menyumbangkan proton (H+). Dilansir dari Chemistry LibreTexts, asam yang kehilangan proton berubah menjadi basa konjugasinya. Misalnya, senyawa asam Bronsted HF yang direaksikan dengan air dengan reaksi berikut: HF (aq) + H2O (l) → F- (aq) + H2O+ (aq). Dalam reaksi tersebut, proton dari.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
Teori Asam Basa Bronsted-Lowry, Pasangan Asam-Basa konjugasi Bronsted-Lowry dan Keunggulan Konsep Asam Basa Bronsted-LowryMateri lain yang berhubungan dengan.